TL1A又称TNFSF15,是肿瘤坏死因子家族的一员。它在不同的免疫细胞中表达,如单核细胞、巨噬细胞、树突状细胞、T细胞和非免疫细胞,如滑膜成纤维细胞、内皮细胞。TL1A与死亡受体3或诱饵受体3竞争性结合,为下游信号通路提供刺激信号,进而调控效应细胞的增殖、活化、凋亡和细胞因子、趋化因子的产生。最近的研究发现,TL1A在自身免疫性疾病中异常表达,包括类风湿关节炎、炎症性肠病、牛皮癣、原发性胆汁性肝硬化、系统性红斑狼疮和强直性脊柱炎。进一步进行体内和体外研究证明TL1A参与了这些疾病的发生和发病机制疾病[1]。
近岸蛋白提供TL1A系列靶点蛋白,适用于靶向抗体药物研发、功能评估和质量控制等不同环节的需求。此外,近岸蛋白还提供多种TNF超家族成员蛋白(TNF-α、4-1BB ligand、CD40 ligand、LIGHT、TRAIL、APRIL、BAFF、RANK ligand、OX40 ligand、FAS ligand、CD27等)及参考抗体,为您的抗体药物研发提供高性能的工具。
靶向TL1A的药物研发进展
截至2025年6月17日,全球靶向TL1A的单抗药物研发进展如下:2款药物(默沙东的Tulisokibart和辉瑞的Afimkibart)处于临床III期;2款处于临床II期;7款处于临床I期;另有25款处于临床前阶段。这显示出TL1A靶点具有巨大的潜在市场。
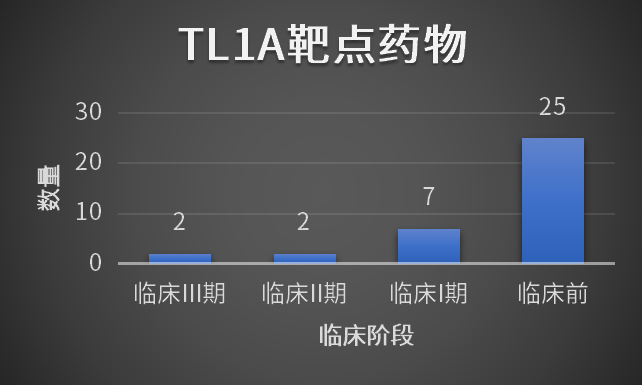
靶向TL1A药物全球研发管线进展
(数据来源药渡)
早在今年1月9日,三生国健自主研发的TL1A单抗临床试验申请获国家药品监督管理局受理,是国内第一个申报临床试验的TL1A单抗。在国内,靶向TL1A的药物基本处于临床前阶段;适应症主要集中在克罗恩病、溃疡性结肠炎和炎症性肠病;药物类型也均为抗体。
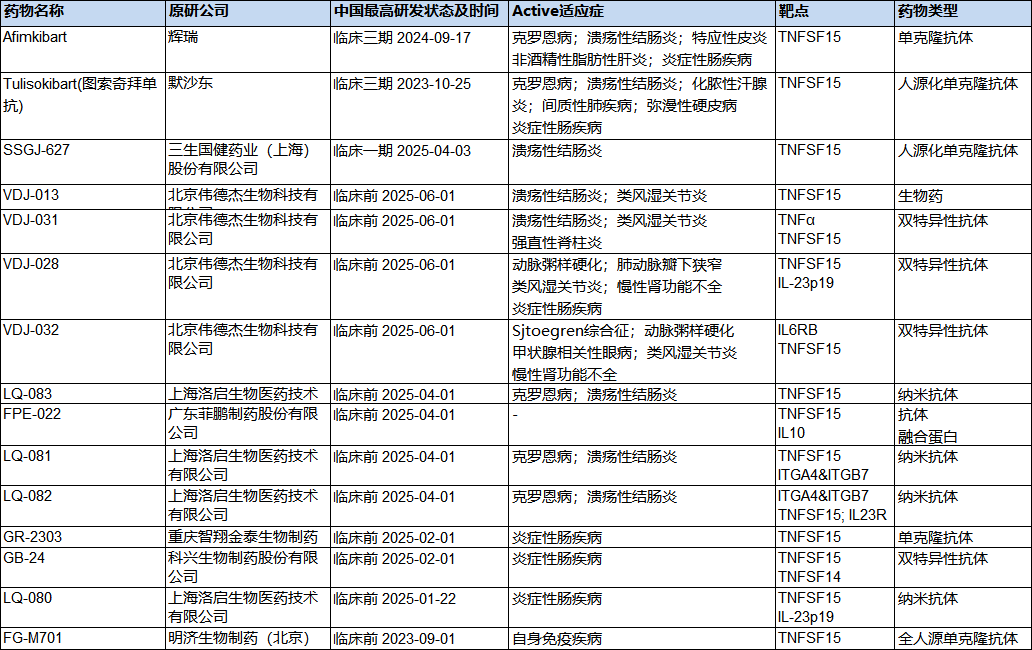
国内靶向TL1A药物的临床进展
(数据来源药渡)
TL1A信号通路
TL1A与受体DR3结合,激活TRADD通路。该复合物通过调节下游通路TRAF2、RIP1、PI3K、MAPKs、NF-kB等发挥促炎作用,进而调节细胞因子、趋化因子的分泌。TL1A/DR3通过FADD、RIP3、Caspase-8/-3/-7等途径参与促进细胞凋亡和坏死细胞死亡。NF-kB可激活c-IAP蛋白,负向调控细胞凋亡[1]。
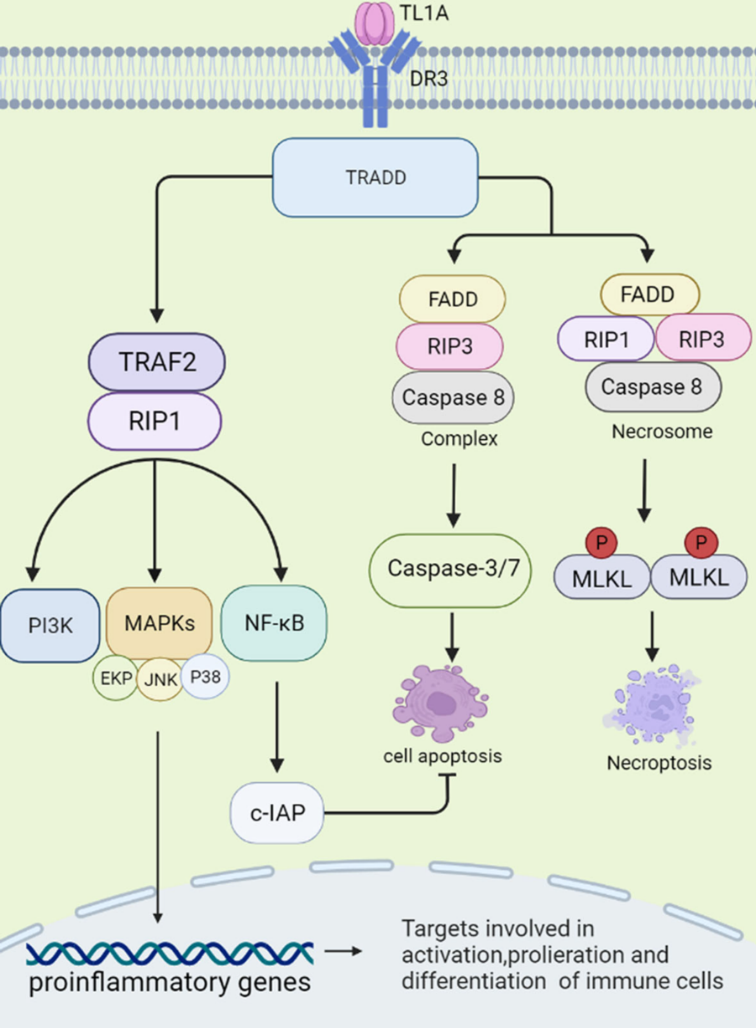
图1. TL1A/DR3启动的信号转导[1]
TL1A/DR3系统作为粘膜免疫反应、过敏和自身免疫的中枢调节因子。TL1A不是组成性表达,而是通过微生物和非微生物抗原刺激后在粘膜APCs(和其他类型的免疫细胞)中诱导表达。TL1A与功能性受体DR3结合,DR3由各种淋巴细胞群激活后表达。TL1A/DR3信号通过应答淋巴细胞促进增殖并优化细胞因子产生,作为一个共刺激系统放大TCR或细胞因子提供的信号。这一功能在次优淋巴细胞刺激条件下尤为重要。所有类型的效应T细胞(Teff: Th1, Th2, Th9, Th17)都对TL1A的刺激有反应。DR3也由调节性淋巴细胞(Tregs)表达,它们对TL1A的反应是增殖的,尽管这可能伴随着抑制功能的暂时停止,特别是在急性炎症的情况下。DR3在先天淋巴样细胞(ILCs)中也有表达,DR3信号影响其功能。最后,在NK细胞和NK-T细胞以及CD8+淋巴细胞中也报道了TL1A/DR3信号通路。这种DR3在先天和适应性效应和调节群体中的普遍表达暗示了TL1A/DR3系统在粘膜免疫中的关键调节作用。此外,来自动物模型的实验数据和来自患者的转化数据表明,TL1A/DR3系统在过敏性肺部炎症和自身免疫性疾病(如克罗恩病、溃疡性结肠炎、类风湿性关节炎和牛皮癣)中发挥了重要作用[2] 。
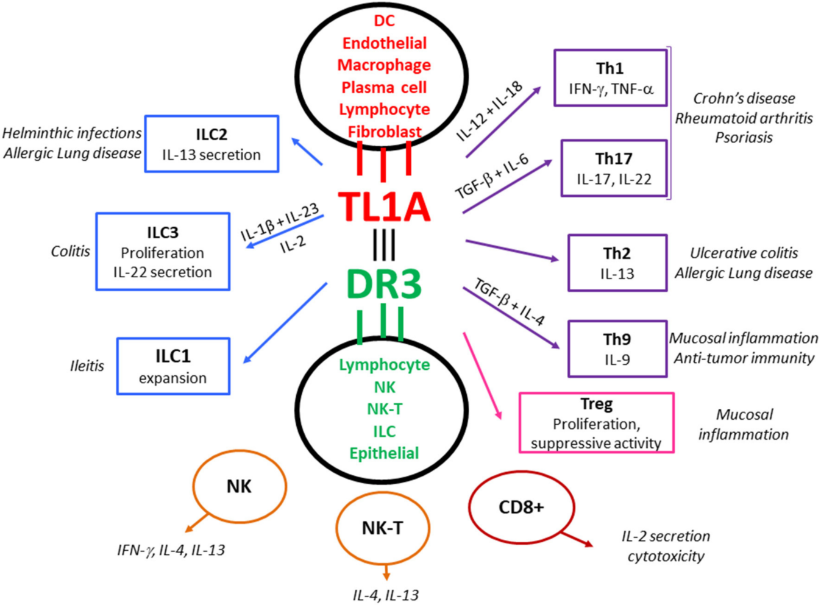
图2. TL1A/DR3在免疫系统中的调节作用[2]
部分数据展示
ELISA验证
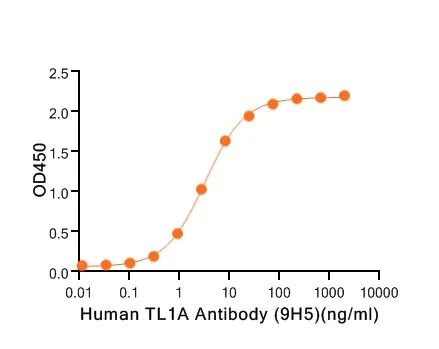
Immobilized Recombinant Human TL1A (N-6His)(C27H) at 2μg/ml (100 μl/well) can bind Human TL1A Antibody (9H5)(NC092). The ED50 of Human TL1A Antibody (9H5)(NC092) is 3.25 ng/ml. (Regularly tested)
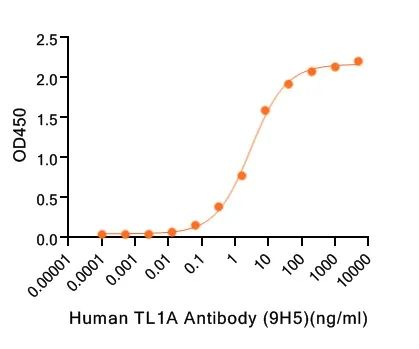
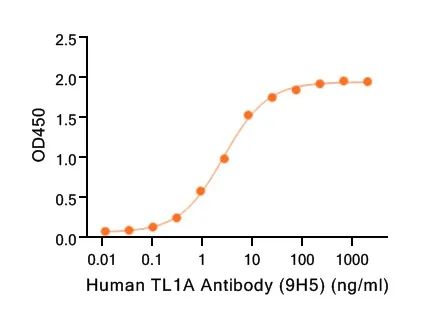
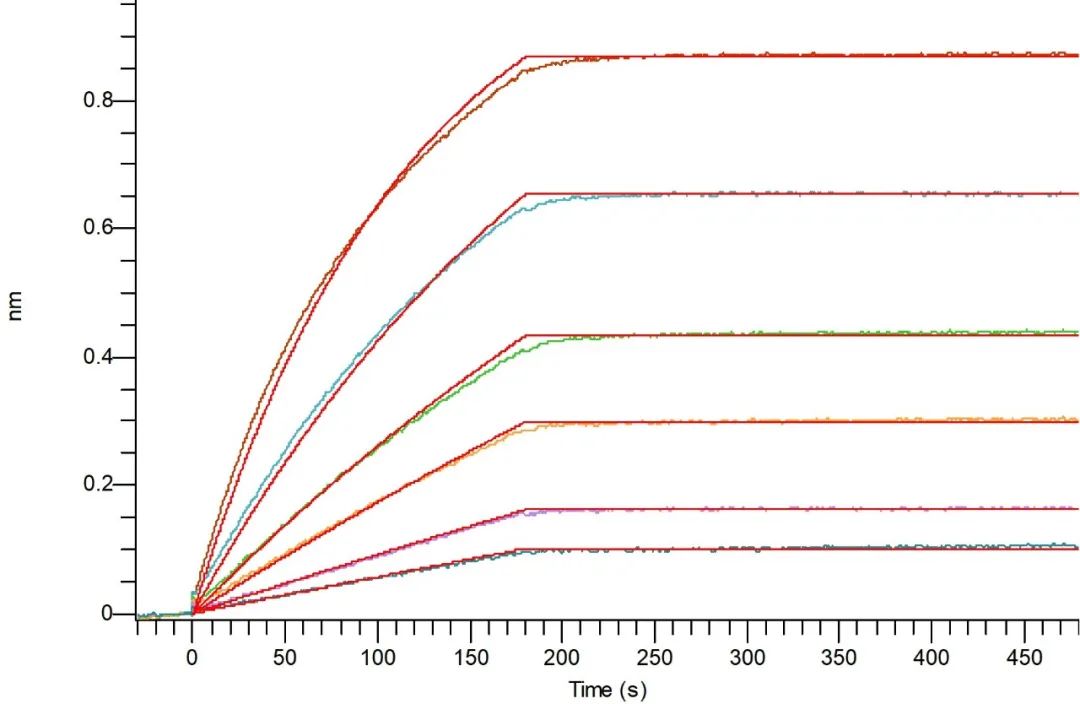
BLI验证
相关产品
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
参考文献
[1]Xu, Wang-Dong et al. “Role of TL1A in Inflammatory Autoimmune Diseases: A Comprehensive Review.” Frontiers in immunology vol. 13 891328. 14 Jul. 2022, doi:10.3389/fimmu.2022.891328
[2]Valatas, Vassilis et al. “TL1A (TNFSF15) and DR3 (TNFRSF25): A Co-stimulatory System of Cytokines With Diverse Functions in Gut Mucosal Immunity.” Frontiers in immunology vol. 10 583. 27 Mar. 2019, doi:10.3389/fimmu.2019.00583
